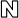셀트리온 ‘허쥬마’, 오리지널 의약품과 동등성 입증


유럽종양학회서 조기 유방암 환자 대상 임상 결과 발표
셀트리온은 9일(현지시간) 스페인 마드리드에서 개최된 유럽종양학회(ESMO)에서 이 같이 내용이 담긴 허쥬마의 조기 유방암 환자 대상 1년 안전성 추가 임상결과를 발표했다고 11일 밝혔다. 허쥬마는 유방암과 위암 치료에 쓰이는 항암 항체 바이오시밀러다. 오리지널 의약품은 제넨텍이 개발하고 로슈가 판매하는 유바암 치료제 ‘허셉틴’이다. 연간 7조9000억원의 매출을 기록하는 세계적인 블록버스터 의약품이다. 셀트리온은 지난해 10월 유럽의약품청(EMA)에 판매 허가를 신청했다.
셀트리온에 따르면 허쥬마 임상은 지난 2014년 6월부터 프랑스, 이탈리아 등 22개국 549명의 조기 유방암 환자를 대상으로 진행됐다. 환자를 무작위로 두 그룹으로 나눈 뒤 바이오시밀러와 오리지널 의약품을 각각 투여해 약효를 비교하는 식이다. 그 결과 유방과 겨드랑이 림프절의 암세포가 완전히 사라진 것으로 확인된 환자 비율은 허쥬마 투여군에서는 46.8%, 오리지널 의약품인 허셉틴 투여군에서는 50.4%로 나타났다.
미국 식품의약국(FDA)과 유럽 EMA에서 요구하는 비율검증과 차이검증에서 동등성 입증을 위해 설정한 마진 구간을 모두 만족한 것이다. 이로써 허쥬마와 오리지널의약품 간 효능 면의 동등성이 입증됐다는 게 셀트리온 측의 설명이다.
또 수술 후 1년간 허쥬마를 투약한 결과 질병이 악화되거나 재발하는 비율이 허셉틴을 투약한 경우와 차이가 없었고, 1년간 장기 투약 시 안전성, 심장독성 및 면역원성에서도 두 군간 차이가 없음이 입증됐다.
허쥬마는 국내에서 2014년 1월 식품의약품안전처의 허가를 받고 올해 하반기 국내 출시를 준비하고 있다.
노은희 기자 selly215@viva100.com