셀트리온, 바이오시밀러 ‘허쥬마’ 유럽 판매허가 승인


|
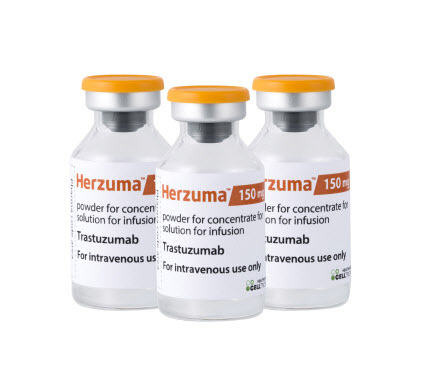
셀트리온은 유방암 치료용 바이오시밀러(바이오의약품 복제약) ‘허쥬마(CT-P6, 성분명 트라스트주맙)’가 13일(현지시간) 유럽의약품청(EMA)으로부터 판매허가를 승인받았다고 14일 밝혔다. 지난해 12월 유럽의약품청 산하 약물사용자문위원회(이하 CHMP)로부터 허쥬마의 허가승인 권고 의견을 받은 지 뒤 약 두 달여만이다.
유럽의약품청은 허쥬마를 조기 유방암과 전이성 유방암, 전이성 위암 등에 쓸 수 있도록 승인했다. 셀트리온은 이번 허쥬마의 유럽 판매 허가승인으로 영국, 독일, 이탈리아, 프랑스, 스페인 등 유럽 주요국을 포함한 유럽연합(EU) 28개국과 노르웨이, 아이슬란드, 리히텐슈타인이 속한 유럽경제지역(EEA) 3개국 등 유럽 총 31개국에서 별도의 허가승인 절차 없이 허쥬마를 판매할 수 있다.
허쥬마는 선발 제품인 자가면역질환 치료용 바이오시밀러 ‘램시마’와 혈액암 치료용 바이오시밀러 ‘트룩시마’에 이어 유럽 시장에 진출하는 셀트리온의 세 번째 바이오시밀러 제품이다. 오리지널 의약품은 제넨테크가 개발하고 로슈가 판매하는 바이오의약품 ‘허셉틴’이다. 허셉틴은 연간 약 8조1500억원의 매출을 올리는 대형 품목으로, 유럽 시장 규모는 약 2조4500억원으로 추산된다.
셀트리온은 그간 해외 파트너사와 허쥬마의 유럽 출시를 준비해왔으며, 허가에 따라 즉시 상업화에 돌입할 예정이다. 현지 판매는 기존에 램시마, 트룩시마를 유럽에서 판매하던 먼디파마, 바이오가랑, 오라이온, 컨 파마 등의 파트너사가 맡을 것으로 보인다.
셀트리온은 트룩시마가 항암 바이오시밀러에 대한 의심을 극복하고, 조기에 시장점유율을 확대하고 있는 만큼 허쥬마도 비슷하게 성장할 것으로 기대하고 있다. 특히 램시마, 트룩시마, 허쥬마 등 3종 바이오시밀러 출시로 시장을 선도하는 것은 물론, 성장 잠재력이 큰 대규모 시장에 진입한 것으로 보고 있다. 셀트리온에 따르면 이들 3종 바이오시밀러의 오리지널 제품은 전 세계에서 약 25조원 규모의 시장을 형성하고 있다.
서정진 셀트리온그룹 회장장은 지난 8일 해외 파트너사들과 만나는 자리에서 “올해는 램시마, 트룩시마, 허쥬마 3종이 유럽 시장에 선보이는 원년”이라며 “앞으로도 연구개발과 상업화에 전력을 다해 바이오의약품의 혜택이 보다 많은 환자에게 제공될 수 있도록 글로벌 리딩 바이오 기업으로 성장해 나갈 것”이라고 밝혔다.
강진 기자 jin90g@viva100.com