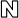신풍제약, 뇌졸중치료제 ‘SP-8203’ 2a상서 안전성 입증
2018-05-18 20:30 김선영 기자
손주혁 연세암병원 교수 “진단키트, 신약과 함께 개발해야”
2018-05-18 18:53 김선영 기자
노바티스 15차 공판, 검찰 심문 무뎠다 … 마케팅 용어풀이 반복
2018-05-18 17:40 김선영 기자
사노피 ‘제브타나주’, 전이성 거세저항성 전립선암 2차치료 급여
2018-05-18 08:33 김선영 기자
신라젠 항암바이러스 ‘펙사벡’, 고형암 1상임상서 내약성 입증
2018-05-18 08:32 김선영 기자
한국엘러간, 신임 지사장으로 김지현 전 레오파마 대표 영입
2018-05-18 08:31 김선영 기자
일동제약, 올릭스와 RNA간섭 기반 황반변성치료제 공동개발 협약
2018-05-18 08:31 김선영 기자
강동경희대한방병원, 만성피로 환자 대상 ‘십전대보탕’ 임상연구 참여자 모집
2018-05-18 08:30 김선영 기자
[병원단신]서울성모병원 ‘콩팥병’ 건강강좌 23일 … 녹색병원 ‘노인성질환’ 23~24일
2018-05-18 08:30 김선영 기자
에스티팜, 산자부·중기부 ‘월드클래스 300’ 기업 선정
2018-05-17 08:56 김선영 기자
식약처, 인공지능 기반 뼈나이 판독기 ‘뷰노메드 본에이지’ 허가
2018-05-17 08:56 김선영 기자
유한양행 프리미엄 건기식 ‘뉴오리진’, 밀크씨슬 등 신제품 3종 출시
2018-05-17 08:55 김선영 기자
대웅제약, 보툴리눔톡신 ‘나보타’ 제조처 美 FDA cGMP 승인
2018-05-17 08:54 김선영 기자
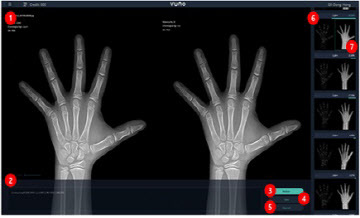
[비바100] 한국얀센-노바티스-릴리, 건선치료제 1위 '공성전'
2018-05-17 07:00 김선영 기자
부광약품, 캐나다 오르카파마 투자 … 최대 330억원 수익
2018-05-16 10:28 김선영 기자
[병원단신] 아주대병원 ‘알레르기질환 진단과 치료’ 건강강좌 23일
2018-05-16 10:27 김선영 기자
GSK, 국내 최초 COPD 3제 복합제 ‘트렐리지’ 허가
2018-05-16 10:27 김선영 기자
[의학단신] 차바이오텍, 1분기 매출 1104억원 … 19% 증가, 영업이익 101억원
2018-05-16 10:25 김선영 기자
일동제약, 기억력 개선 건기식 ‘마이니 메모리 지피에스’ 출시
2018-05-16 10:24 김선영 기자
유한양행, 건기식 브랜드 ‘뉴오리진’ 론칭 여행 이벤트
2018-05-16 10:23 김선영 기자
랭킹뉴스