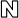보스톤사이언티픽, 파킨슨병 치료 두개강내 신경자극기 ‘버사이즈’ 2종 출시
2018-06-05 09:24 김선영 기자
삼성바이오에피스, HER2+ 유방암치료제 ‘SB3’ 1년추적 임상결과 발표
2018-06-03 14:41 김선영 기자
녹십자지놈, 신임 대표에 기창석 前 삼성서울병원 교수 내정
2018-06-03 14:41 김선영 기자
신라젠, 美 신장암 1b상 환자 모집 … ‘펙사벡’·‘REGN2810’ 병용 연구
2018-06-03 14:40 김선영 기자
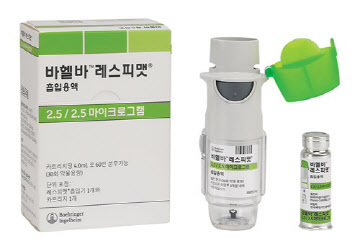
베링거 COPD치료제 ‘바헬바’, 운동능력 향상시켜 … LAMA/LABA 복합제
2018-06-02 09:03 김선영 기자
레오파마, 에어로솔 폼 제형 건선치료제 ‘엔스틸룸’ 출시
2018-06-01 08:44 김선영 기자
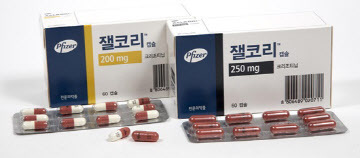
화이자 ALK 양성 폐암치료제, ‘잴코리’, 최장 OS 데이터 확보
2018-06-01 08:43 김선영 기자
레고켐, 그람음성 슈퍼항생제 ‘LCB10-0200’ 하반기 美 1상임상 시작
2018-06-01 08:43 김선영 기자
유나이티드제약, 건기식 ‘홈타민’ 모조품 불법판매 중국 S사에 법적 대응
2018-06-01 08:42 김선영 기자
에자이, 갑상선암 인식 개선 ‘나비리본 캠페인’ 시작
2018-06-01 08:38 김선영 기자
베링거 "특발성폐섬유증제 ‘오페브’, 1년 후 사망위험 크게 줄어"
2018-05-31 15:50 김선영 기자
시선바이오, 정밀의학에서 전주기 예방의학으로 사업영역 확대
2018-05-31 10:22 김선영 기자
한국화이자 "금연치료 보조제 ‘챔픽스’, CATS 등 3상임상서 심혈관계 안전성 입증"
2018-05-31 10:21 김선영 기자
LG화학, 자가면역질환치료제 ‘엔브렐’ 바이오시밀러 日 최초 출시
2018-05-31 10:17 김선영 기자
동국제약, 에스바이오메딕스 ‘중증하지허혈 세포치료제’ 판권 확보
2018-05-31 10:16 김선영 기자
부광약품·OCI, 제약·바이오 합작법인 설립 … 50 대 50 투자
2018-05-31 10:16 김선영 기자
[비바100] 김동연 부광약품 회장 "증여세 700억 당당히 낸다" 사업성장 자신감
2018-05-31 07:00 김선영 기자
길리어드 C형간염치료제 ‘하보니’, 유전자형 1형 전체로 급여 확대
2018-05-30 09:59 김선영 기자
젊은 여성암 환자, 복지부 항암제 ‘선별급여제도’ 혜택 볼까
2018-05-30 09:57 김선영 기자
바이오협회 “탄력적 R&D 회계처리 기준 적용해야”
2018-05-30 09:05 김선영 기자
랭킹뉴스