환자안전 거론된 ‘혁신의료기술 별도 평가체계’…철저한 사후평가·검증절차 관건


|
혁신의료기기의 빠른 시장진입을 돕기 위한 ‘혁신의료기술 별도 평가체계’ 도입을 앞두고 환자 안전 문제에 대한 우려의 목소리가 나오고 있다.
11일 복건복지부에 따르면 내년 1월 시행을 목표로 혁신의료기술 별도 평가체계가 구축 중이다. 기존 연구가 부족해도 기술 혁신성 등이 높은 경우 조건부 신의료기술로 인정해 ‘선진입-후평가’로 신속한 시장진입을 돕고자 정부가 나선 것이다. 그 동안 기업들은 혁신의료기기를 개발해도 긴 평가기간으로 시장진입의 어려움을 호소해왔다.
그러나 의료계는 환자 안전에 대한 문제를 내세우며, 혁신의료기술로서 ‘검증절차의 중요성’을 강조했다.
박성호 서울아산병원 교수는 “산업계의 입장을 반영해 별도 트랙을 만들었지만 철저한 검증이 안된 의료기기가 현장에서 문제가 생겼을 경우 모든 책임은 의사가 떠안게 되는 것”이라며 “이와 관련한 법적절차 마련도 없는 상황에서 환자에게 쓰이는 신의료기술은 신중할 필요가 있다”고 말했다.
이번 평가체계가 성공적으로 정착되기 위해서는 선진입 후 진행되는 후속 평가의 형태가 중요한 관건이 될 것이라는 의견도 나왔다.
오주형 경희대병원 영상의학과 교수도 “의료산업발전을 위해서는 첨단혁신기술들의 신속한 시장진입이 필요하지만 사람의 생명을 다루는 분야인 만큼 보수적인 시각도 필요하다”며 “별도 평가체계로 시장진입을 했을 때 사후평가가 제대로 될 수 있도록 제도적 인프라가 확실하게 구축되어야 성공할 수 있을 것”이라고 조언했다.
의료계·산업계 간 소통의 중요성도 꼽혔다.
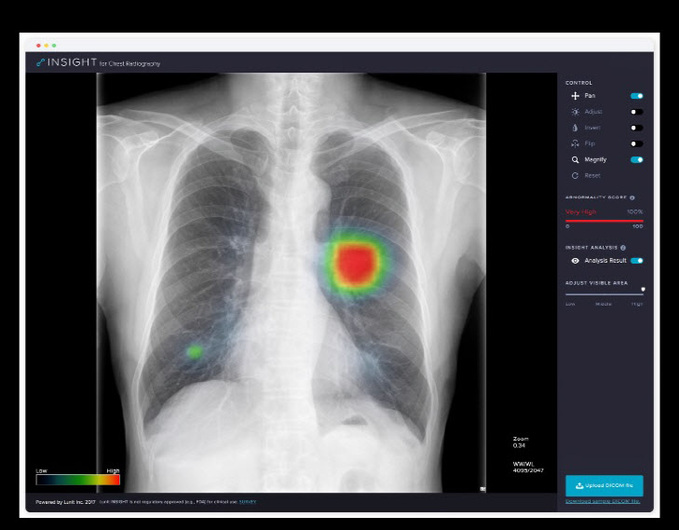
김기환 루닛 이사는 “좋은 기술이 있어도 의료 현장에 필요한지, 또 어떻게 쓰이는지가 중요하다”며 “현장에서 필요한 기술, 임상시험 디자인 등 연구자와 의료진들의 소통이 필요하다”고 강조했다.
또 다른 AI의료기기 개발자도 “앞으로 혁신의료기기가 발전하기 위해선 의료와 기술분야의 협력은 필수 조건”이라고 말했다.
복지부는 이 같은 평가체계 도입에 다양한 의견을 수용하겠다는 입장이다.
복지부 관계자는 “환자 안전이 최우선이기 때문에 산업계입장을 대변하고 있다는 의견은 오해”라며 “산업계, 의료계, 시민단체들의 의견을 적극적으로 수용하겠다”고 말했다.
노은희 기자 selly215@viva100.com